 03-31-2014, 04:11 PM
03-31-2014, 04:11 PM
|
المشاركة رقم: 1
|
| المعلومات |
| الكاتب: |
|
| اللقب: |
عضو مميز |
| الرتبة |
|
| البيانات |
| التسجيل: |
Feb 2014 |
| العضوية: |
1681 |
| المشاركات: |
1,192 [+] |
| بمعدل : |
0.28 يوميا |
| اخر زياره : |
[+] |
| الإتصالات |
| الحالة: |
|
| وسائل الإتصال: |
|
|
المنتدى :
المنتدى الزراعي العام
الزراعة بالانسجة ، التكاثر عن طريق الزراعه بالانسجة
الزراعة بالانسجة ، التكاثر عن طريق الزراعه بالانسجة

نقدم لكم موضوع هام جدا علي

يختص بـ
الزراعة بالانسجة ، التكاثر عن طريق الزراعه بالانسجة
لكل من يهمه الامر
ونترككمم ع الموضوع
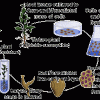
للحصول على السلالة الخضرية يتبع فى تكاثرها عدة وسائل منها زراعة الأبصال والدرنات والكورمات والمدادات والريزومات وتكوين الجذور العرضية على العقل والتطعيم و يضاف إلى ذلك التقنية الجديد المعروفة بزراعة الخلايا والأنسجة والأعضاء.
أهم الاختلافات بين وسيلة زراعة الأنسجة والوسائل التقليدية للتكاثر ما يلى :
1- صغر حجم الجزء المستعمل فى التكاثر Propagules .
2- تتم الزراعة فى وسط مائى " على بيئة سائلة أو شبه سائلة ".
3- تتم الزراعة تحت ظروف معقمة وتحت ظروف بيئية " حرارة وضوء " مناسبة.
4- استخدام تلك الوسيلة للتكاثر ويمكن إنتاج أعداد كبيرة إذا ما قورنت بالطرق التقليدية.
5- خلو النباتات الناتجة بذلك التكنيك من الأمراض Pathogen free plants .
6- سهولة الاحتفاظ بتلك النباتات وتخزينها لحين الحاجة إليها.
وهناك فائدة نجنيها من استخدام هذا التكنيك فى التكاثر وهو انخفاض تكلفة الإنتاج مقارنة بالطرق التقليدية والتى تتميز بارتفاع أثمان النباتات الناتجة كما فى نباتات الزينة وبعض أنواع الفاكهة الممتازة فى صفاتها والمرغوبة تجارياً أو التى يصعب تكاثرها بالطرق التقليدية أو التى إنتاجها قليل من الفسائل مثلاً كالنخيل والذى يبلغ ثمن الفسيلة فى بعض أنواعه من 50 – 100 جنيه فضلاً على إمكانية إنتاج تلك النباتات دون ارتباط بموسم زراعى كما يحدث عند التكاثر بالوسائل التقليدية. كذلك خفض تكلفة الإنتاج للنباتات تساعد أيضاً مربى النبات على إنتاج نباتاته المحسنة, فمثلاً وجد أن نبات البطيخ ثلاثى المجموعة الكروموسومية يتكلف 1.6 إلى 2.5 دولار تنخفض تلك التكلفة للعشر باستخدام تلك التقنية فى تكاثر نبات البطيخ الثلاثى.
وللوصول لهذه الغاية هناك عدة مسالك وطرق للحصول نباتات السلالة الخضرية Alternative method of colnal multiplication
أ – Callus production Pathway
فيها تزرع Explant للحصول على الكلس خلال Stage І أما Stage ІІ حينما يكون الغرض هو الزيادة العددية للمادة المتكاثرة فيتم نقل أجزاء من الكلس على نفس البيئة " وحوالى 0.5 جرام من الكلس " لاستمرار نموها وزيادة Propagules ثم تنقل على بيئة جديدة يتغير فيها مكونات البيئة من حيث المستوى الهرمونى والفيتامينات .
أعلى الصفحة
وقد تتغير الاحتياجات البيئية لتكوين النموات الخضرية العرضية Adventitious shoot على الكلس خلال Stage Ш يعزل كل Shoot منفرد على بيئة تساعدة على تخلق الجذور عليه خلال مع التقسية لإمكان نقلها للتربة .
هذه الطريقة بالرغم من سهولتها وإمكان إنتاج أعداد وفيرة من النباتات منها فإنها فى بعض الحالات لا تنتج النباتات المطلوبة نظراً لتغير صفات النباتات الناتجة لحدوث تضاعف العدد الكروموسومى عند انقسام بعض الخلايا. لذلك وجد أن الأنسجة المتشابهة تشريحياً فى محتواها من الخلايا تكون كلس متجانس متشابه أما الأجزاء النباتية التى تحتوى على أنواع عديدة من الأنسجة سوف تكون كلس مختلط ومتنوع ومتضاعف ينتج عن نباتات تختلف وراثياً عن الآباء. وعليه فإن اختيار الأجزاء النباتية يجب أن يتم بكفاءة من حيث تركيبها حتى يمكن إنتاج كلس متجانس مطلوب.
ب - Axillary brunching pathway
دون المرور بمرحلة تكوين الكلس كما فى الطريقة السابقة يتم زراعة المنفصل النباتى وفى الغالب القمة النامية أو البرعم الجانبى لينمو مباشراً إلى أفرع خضرية وذلك فى Stage І أما Stage ІІ ولزيادة Propagules ينقل الـ Shoot Axillary المتكون من المرحلة الاولى إلى بيئة تساعد على تكون النموات الجانبية على ذلك النمو الخضرى Axillary branch بعداد مضاعفة ثم تعزل كل Shoot على حدى وتنقل مرة أخرى على نفس البيئة فتتكون عليها عدد آخر من Axillary shoot ، وذلك خلال Stage ІІ ثم فى Stage Ш ينقل كل Shoot على بيئة تخليق الجذور .
ج – Somatic embryogenesis pathway
يتم زراعة Explant على بيئة مناسبة تدفع المنفصل النباتى الى تكوين الأجنة العرضية مباشرا أو يتكون Callus خلال Stage І ثم تنقل على بيئة غذائية لإنماء الأجنة خلال Stage ІІ ,Ш أو تتكون الأجنة من الكلس .
وسوف نتحدث عن كل طريقة بشئ من التفصيل.
أعلى الصفحة
أ- Callus production pathway
يتكون الكلس عند زراعة Explant على بيئة غنية بالأكسين (1 – 10 مليجرام / لتر) ويفضل استخدام 2,4-D لدورة الواضح فى إنتاج الكلس مع مستوى منخفض من السيتوكينين بتركيز من 0 – 10 مليجرام / لتر ويفضل استخدام BA
ويمكن إضافة الأكسين منفرداً خاصة إذا استعمل فى صورة 2,4-D ولكن نظراً لدور الأكسينات فى تثبيط تكون النموات الخضرية Shoot formation لذلك ينقل الكلس بعد تكونه على بيئة محتوية على مصدر أكسينى آخر غير2,4-D مثل استخدام NAA أو IAA .
لتكوين النموات الخضرية العرضية Adventitious shoot تنقل خلال Stage ІІ على مستويات متكافئة من الأكسين والسيتوكينين 2 – 3 مليجرام / لتر لكل منهما وفى بعض الحالات تنقل على بيئة عالية من السيتوكينين ومنخفضة من الأكسين .
خلال Stage ІІ يمكن تشجيع تخليق النموات الخضرية بإضافة Adenine sulphate بتركيز 150 مليجرام / لتر ، وكذلك إضافة Casein hydralysate بتركيز 500 – 1000 مليجرام / لتر وأيضاً من المفيد إضافة Tyrosine بتركيز 1 – 10 مليجرام / لتر فهى تساعد على تخليق النموات الخضرية Shoot proliferation .
يلاحظ أثناء تخليق النموات العرضية أنة قد يصاحبها تكون كلس , هذا يعنى أن مستوى الهرمون خاصة الأوكسين منه عالى أكثر من اللازم Level are too high – ولو أن ذلك ليس بالقاعدة العامة ففى كثير من النباتات يتكون الكلس نتيجة حساسية تلك النباتات للجروح فيتكون الكلس عند السطوح المجروحة
خلال المرحلة الثالثة Stage Ш تنقل Shoot المتكون من المرحلة السابقة على بيئة جديدة لتكوين الجذور العرضية تلك البيئة تمتاز بمستواها المنخفض من الأملاح ( 1/4 ، 1/3 تركيز الأملاح فى البيئة المستخدمة خلال Stage І , Stage ІІ ) مع إضافة الأكسين فقط.
يستعمل IAA بتركيزات فى حدود 10 مليجرام / لتر وكذلك NAA , IBA بتركيزات فى حدود 0.1 – 3 مليجرام / لتر.
ترفع الإضاءة من 1000 – 10000 Lux مع إضافة الفحم النشط فى Ш Stage كذلك وجد من المفيد أيضاً إضافة بعض الفينولات مثل Caffice acid , phloroglucinal فهى تساعد على التخليق الجيد للجذور .
ب – Axillary shoots pathway
تؤخذ القمم النامية من بادرات النباتات بطول 1 – 5 مم أو قطاعات من الساق أو الجذر كمنفصل نباتى Explant وتزرع على بيئة غذائية ذات مستوى منخفض من السيتوكينين 0.05 – 0.5 مليجرام / لتر BA ومنخفض من الأكسين 0.01 – 0.1 مليجرام / لتر IBA أو تزرع Explant على بيئة ذات مستوى هرمونى متوسط من كل من الأكسين والسيتوكينين ( 2 مليجرام / لتر NAA + مليجرام / لتر Kinetin ) .
تنمو Explant إلى Shoot proliferated يفصل كل منها وتزرع على بيئة جديدة لزيادة Propagules فتتكون النموات الجانبية Axillary shoots وتكون البيئة بنفس التركيزات السابقة أو مستوى أعلى من السيتوكينين بالنسبة للأكسين 0 – 3 مليجرام IAA وفى تلك المرحلة يفضل استعمال N, isopentenyl adenine ) 2 ip ) كمصدر للسيتوكينين . ولكن ذلك ليس بقاعدة عامة فالتركيزات والهرمونات المستخدمة تختلف باختلاف النباتات كما هو مبين بالجدول (10) وقد أشار Hussey & Hepher 1978 إلى وجود استثناء على نبات Brassica mapus حيث أمكن تخليق Axillary shoot على بيئة ذات مستوى من السيتوكينين فقط بدون إضافة أكسين ويضاف السيتوكينين فى صورة BA بتركيزات تتراوح بين 0.25 – 1 مليجرام / لتر.
من الدراسات الهامة فى هذا المجال وجد أن زيادة السكر يقلل من عدد النموات الجانبية المتكونة كما وجد Davies 1980 أن أنسب تركيز للسكر كان 4 % .
وفى دراسة لنفس الباحث السابق ذكرة على سبع أصناف من الورد وجد أن الإضاءة العالية 1000 Lux خلال Stage ІІ أدت إلى إعطاء أوراق كبيرة فى الحجم وكان تخليق Axillary shoot فقيراً بالمقارنة لشدة الإضاءة المنخفضة 400 Lux عند اسنخدام نفس التركيزات من الهرمونات فى خلال Stage Ш
تنقل Shoot كلا على حدى على بيئة جديدة لتكوين الجذور وهى بيئة تحتوى على الأكسين مثل NAA بتركيزات تتراوح بين 0.25 – 0.5 مليجرام / لتر مع زيادة شدة الإضاءة من 1000 – 10000 Lux .
أعلى الصفحة
جدول (10) يبين تركيز الهرمونات المستخدمة فى كل مرحلة من مراحل التكاثر المختلفة
Stage Ш
Stage ІІ
Stage І
Plant
IAA 11.5 Mm
Kg.3Mm+IAA 0.28uM
Ls medium + k 4.4um + IAA .28 uM
البطيخ
Water melon
NAA 0.1 ppm
No changes
Ms + k 2ppm + NAA 0.04 + GA 0.1 ppm
الورد
Rose
NAA0.5 ppm or NAA0.25+IBA0.25ppm
Ba 0.25-0.4 or NAA0.1+ME500ppm
Ms + k 0.25 + NAA 2 - 5 ppm
الموالح
Citrus
NAA 0.5 ppm
Ms+IAA1.0+2ip10+Admin SO4 26.84 thiamine 0.4
MS + IAA 1.0 + BA 1.0 ppm
البجونيا
Begonia
IAA10 ppm + Tyrasine124 -30
Ms + IAA 0.5+k10+ Admin SO4 71-59+ Tyrasine124-30
MS + IAA 0.5 + k 1.0
الجربيرا Gerbera
NAA or IBA2ppm + 0-25 3% charcoal
Ms + BA 5 ppm or No change
Ms + BA3 or IAA2 + k 2.0 ppm
الموز
Banana
IBA 1 ppm
IBA+ BAI or IAA2.5 ppm + k 0.1 ppm
IBA + BA 0.1 or IAA 1.0 ppm
الفراولة Strawberries
بدون هرمون + 1000Lx
0.3IAA + k 1.0 ppm
0.1 IAA + k 0.1 ppm
القرنفل Carnation
IBA 0.5 ppm
No change
IAA 0.3 + 2ip 30 ppm
الفيكس
Ficus
NAA 0.1 ppm
No change + BA 8 ppm
0.0 NAA + BA 2 ppm
الورد
Rose
IBA or NAA, NOA 10uM + phleroglucnel
No change
BA 5-10 um
التفاح
Apple
AA0.2 or NAA0.2 + 2ip 0-0.1 ppm
2ip 0.5 ppm
2ip 0.5 ppm + NAA 0.1 ppm
الثوم
Garlic
No change
NAA 0.1 + k 2 ppm
NAA 2 + k 5.0 ppm
NAA 2 + k 1.0 ppm
الطماطم
Tomato
-
-
NAA0.01 or 1 ppm + k 5-10 ppm
البطاطس
Potato
جـ- Somatic embryogenesis pathway
تتكون الأجنة الخضرية كما يتكون الأجنة الجنسية من البيضة المخصبة أو الزيجوت ولكن ينقصها أغطية البذرة. وتتكون الأجنة الخضرية طبيعياً مثل الأجنة النيوسيلية فيما لا تقل عن 60 عائلة وتشمل 140 جنس ، 246 صنف . ومعروف الآن 21 عائلة أمكن من إنتاج الأجنة الخضرية خلال زراعة الأنسجة هذه الأجنة يمكن الحصول عليها مباشرة من زراعة Explant أو بعد تكوين الكلس كخطوة وسيطة وبتلك الوسيلة قد يمكن إنتاج ما يقرب من 1000 جنين / لكل جرام من الخلايا المزروعة وقد تصبح هذه الوسيلة هى الأساسية خاصة فى المحاصيل التى لا تتكاثر إلا عن طريق البذور تجارياً.
إن الاستعداد الوراثى عامل يجب ألا نغفله عند الرغبة فى الحصول على الأجنة الجسيمة من زراعة الأنسجة فقد وجد أن عدد الأجنة من ذلك التكنيك تزيد فى C. sinensis عن C. aurantifolia وهذا متمشياً مع درجة تعدد الأجنة فى بذورها طبيعياً حيث أنها صفة وراثية .
يلزم لهذه الأجنة أن تمد بأغطية صناعية حتى يسهل تداولها ويمكن تخزينها.
فى المرحلة الأولى تزرع Explant على بيئة ذات مستوى منخفض من الهرمونات فتتكون مبادئ خروج الأجنة العرضية ويستعمل الـ 2,4-D كمصدر للأكسين 1 – 10 مليجرام / لتر 2,4-D وتركيز منخفض من السيتوكينين 0.0 – 0.1 مليجرام / لتر BA
فى المرحلة الثانية Stage ІІ حيث يكون الغرض هو زيادة الأعضاء المتكاثرة Increasing propagules يتم نقل الأجنة الخضرية المتكونة من المرحلة السابقة لإحداث المزيد من الأجنة أما فى حالة إنتاج الكلس ولكى يزيد نسبة تكوينه ينقل أجزاء منه حوالى 50 – 100 مليجرام على نفس البيئة ثم تنقل الكلس على بيئة لتخليق الأجنة أو لتكوين أعضاء تشبه الأجنة والأبصال الكاذبة Embryoid like organs or pseudobublis , كما تتكون الاجنة من زراعة Explant من الموالح ( البرتقال الشموتى ، النازج ) على بيئة ذات مستوى من السيتوكينين إلى الأكسين قريب من 100 : 1 , وفى الغالب تتكون الأجنة على بيئة ذات مستوى عالى من الكينتين 2.5 – 0.25 مليجرام ويفضل استعمال BA بتركيزات من 0.1 -1 مليجرام / لتر أو بالإضافة إلى مستوى منخفض من الأكسين بتركيز 0.1 مليجرام فى صورة NAA أو IAA
وجد أنة من المفيد لزيادة تخليق الأجنة الخضرية إضافة Adenine بتركيز 2 مليجرام / لتر أو Adenine sulphate بتركيز 10 مليجرام / لتر مع استعمال تركيز عالى من النتروجين بإضافة نترات الأمونيوم بتركيز 170 مليجرام / لتر وكذلك زيادة تركيز البوتاسيوم . كذلك إضافة مستخلص الشعير بتركيز 500 – 1000 مليجرام / لتر .
وقد وجد Buttan & Barman 1971 أن مستخلص الشعير Malt extract له تأثير منشط على إنتاج الأجنة وكذلك زراعة البويضة غير المخصبة للبرتقال أبو سره . ولم يعرف للآن دور مستخلص الخميرة أو الشعير فى تنشيط تخليق الأجنة ولكن يعتقد أنه يحتوى على واحد أو أكثر من الأحماض الأمينية الهامة .
وجد Rangasuiami 1961 أن السكر بتركيز عالى ضرورى لتشجيع الأجنة فى حين لم يكن له نفس الأهمية عند تنمية الأجنة الكاملة Embryo culture .
أشارت الدرسات على أن الظلام يشجع من تخليق الأجنة الخضراء عند تعريض الزراعات الضوء. ووجد أن التهوية للبيئة المستعملة أمر هام لأن نقص التهوية يؤدى إلى التنفس الهوائى فيتراكم الكحول فيؤدى إلى سمية الخلايا والأنسجة.
خلال المرحلة الثالثة Stage Ш تنقل الأجنة المتكونة على بيئة بسيطة متكونة من الأملاح والسكر والفيتامينات فقد لا يضاف أى هرمونات وقد يضاف حمض الجبرلين لزيادة نمو الأجنة ويزداد الإضاءة قبل نقلها للتربة . وعليه فإنه يمكن بعد هذا العرض نلخص حدود التركيزات الهرمونية المستخدمة فى كل طريقة وفى المراحل المختلفة كما بالجدول التالى:
جدول (11 ) حدود تركيزات الهرمونات المستخدمة فى إكثار النباتات In vitro
Stage
Callus production pathway
Axillary branching pathway
Somatic embryogenesis pathway
Stage І
Auxin (NAA) or 2,4-D 1-10 ppm
Cytokinin (BA) 0.0-0.1 ppm
يفضل استخدام2,4-D منفرداً
Auxin(NAA) 0.01-0.1ppm
Cytokinin0.05-0.5 or
Auxin(NAA)2ppm
Cytokinin (K)2ppm
Auxin (2,4-D)1-10ppm
Cytok - (BA) 0.0-0.1ppm
Stage ІІ
NAA 2ppm +BA 2ppm
IAA 0.2+k2
IAA 0.1+BA1
ويفضل إضافة
Adenine SO4-H2O 150ppm
Casein hydrolysate 500-1000ppm
Tyrosine 1-10ppm
Auxin (IAA) 0.0-0.3ppm
Cytok (2ip) 1-30ppm or BA only 0.25-1ppm
ويفضل إضافة
Adenine SO4-H2O 71-59-150 ppm
Auxin(NAA)0-1
Cytok BA 1-10 ppm or
K0.25-2.5ppm
ويفضل إضافة
Adenine 2 ppm
Adenine sulfate 1.00ppm
Ammonium nitrate 170ppm
Malt extract 500- 1000ppm
Stage Ш
1/3-1/4 Salts of medium
Auxin (IBA,NAA) 0.1-2 ppm
IAA 10 ppm
يفضل لإضافة
Active charcoal 0.3-3%
Phloroglicunal 164ppm
Auxin (NAA) 0.1-0.5 or
IBA 0.1-2 ppm
1/3 Salts
GA 1-10 ppm
أعلى الصفحة
تجديد البيئة الغذائية The subculture
كما سبق ذكره فإن تجديد البيئة الغذائية يجب أن يتم كل ثلاثة أو أربع أسابيع على الأكثر وذلك نظراً لتغير تركيز كل من الهرمونات والعناصر الغذائية فى المنطقة التى يقوم النسيج المزروع Explant بتناول احتياجاته منها بالانتشار وهى المنطقة القريبة من النسيج فضلاً على تغير درجة حموضة الوسط الغذائى مما يؤثر على الانتشار وفسيولوجية الخلايا . مما يستوجب معه نقل النسيج المنزرع أو نواتج نموه مثل الكلس Callus أو النموات الجانبية Axillary shoots أو الأجنة العرضية Somatic embryo على بيئة غذائية طازجة جديدة .
·اصطلح على استخدام مصطلح Subculture عند تجديد البيئة واستخدام نفس التركيزات الغذائية والهرمونية ويصبح نقل العضو المزروع أو النسيج فقط لتنشيطة على بيئة طازجة أما فى حالة تغير احدى مكونات البيئة أو أكثر فيطلق عليها اسم Reculture ولسوء الحظ هناك تجارب تشير إلى تكرار Subculture خاصة للكلس وبعض الأنسجة النباتية يؤدى إلى فقدان قابليتها على التكوين الشكلى Morphogenesis . فقد وجد Wachak and wethere 1975عند زراعة القمم النامية لجذور نبات Isatis tinctaria أن الأنسجة تفقد قابليتها على تكوين الأفرع تدريجياً بإعادة الزراعة لعدة مرات ولكن فى حالات أخرى أمكن استعادة كلس ناتج من زراعة أنسجة Chrysanthemum على التكوين الشكلى بعد مدة طويلة من التخزين.
وقد أقترح فقدان الجزء النباتى على التكوين الشكلى يرجع إلى :
نشأت الكلس والأفرع تتم عادة من الأنسجة المرستيمية الموجودة بالجزء النباتى المزروع Explant والتى تختفى تدريجياً " الأنسجة المرستيمية " بتكرار Subculture ويحل محلها كتلة من الخلايا غير المتميزة والتى لا يكون لديها القدرة على تكوين الحزم الوعائية اللازمة عند تخليق Shoots .
قد يعود فقد القدرة على التخليق المورفولوجى لانخفاض مستوى الفيتوهرمونات الداخلية.
تجمع وتراكم الكروموسومات الغير طبيعية قد يؤدى إلى إعاقة عملية التكوين والتميز فقد لوحظ عند نقل الأنسجة عدة مرات إلى تضاعف العدد الكروموسومى فى تلك الأنسجة كذلك لوحظ تغير الموقع الكروموسومى أو انتقاله.
تخزين الأعضاء المتكاثرة Storage of germplasm
عند الرغبة فى تخزين الأنسجة النباتية لسلالة خضرية ما ناتجة من تكنيك زراعة الأنسجة In vitro لاستخدامها فيما بعد فى التجارب العملية أو المحافظة عليها كمخزن يمكن الحصول منه على نباتات عند الحاجة لذلك تستخدم عدة طرق لتقليل نمو تلك الأنسجة والأعضاء والمحافظة عليها لفترة طويلة وذلك بخفض درجة الحرارة أو تعديل مكونات البيئة الغذائية ، أو بتعديل المحتوى الغازى لأوانى الزراعة .
1- خفض درجة الحرارة Temperature reduction
كما هو معروف فإن نمو الأنسجة النباتية In vitro يتم فى مدى حرارى يتراوح ما بين 20–30°م وعليه فخفض درجة الحرارة عن ذلك يؤدى إلى تقليل معدل نمو تخليق الأعضاء وزيادة الفترة اللازمة لإعادة نقل الأنسجة Subcultures ويتوقف مدى انخفاض درجة الحرارة على النوع النباتى . فقد وجد Galzy 1969 أن درجة حرارة 9 °م كانت أنسب درجة لحفظ أنسجة العنب Vitis rupestris وذلك لمدة عام فى حين كانت درجة حرارة 12 درجة مئوية الأنسب لنباتات Ipome batatas كما أشار بذلك Henshew et al 1980 كما لاحظ الباحث أن درجة حرارة 12 °م نهاراً ، 6 °م ليلاً كانت أفضل من استخدام درجة حرارة 12 °م باستمرار . أما التخزين عند درجة حرارة 14 °م هى أقل درجة حرارة يمكن التخزين عليها فى نبات Manihot esculentum كما أشار بذلك Alan 1979 فى حين أمكن تخزين الأنسجة المرستيمية الناتجة من زراعة Fragaria vesca والنامية على بيئة سائلة باستخدام كوبرى فى الظلام وتحت درجة حرارة تتراوح بين -1 ، 6 م° لمدة 6 سنوات Mullin and schlegel 1976.
2- تعديل البيئة الغذائية Medium modification
أشار Henshow et al 1980 إلى أن هناك العديد من التعديلات على البيئة الغذائية حتى يتوافق ذلك مع غرض تخزين الأنسجة عليها ، أهم تلك التعديلات هو رفع تركيز السكر من 3 إلى 8 % وكذلك زيادة حجم البيئة المستخدمة من 3.5 مل إلى 60 مل ثم التخزين على درجة حرارة 10 °م أما Caplin 1959 فقد أمكنه زيادة فترة Subculture للكلس من 4 أسابيع إلى 5 أشهر باستخدام زيت معدنى لتغطية الكلس بغشاء رقيق منع عنها الأكسجين عن Explant فقللت فترة التخزين .
كما يستخدم المانيتول بتركيز 6 % لرفع الضغط الأسموزى وفى هذه الطريقة يمكن تعريض الأنسجة إلى درجة 2 °م وفى حالات أخرى وجد أنه من المفيد لزيادة فترة تخزين Germplasm إضافة حمض الأبسيسيك بتركيز يتراوح ما بين 5 إلى 10 مليجرام / لتر كما أن إضافة بعض الزيوت المعدنية مفيدة فى إبطاء نمو كلس نبات Daucus carata كذلك لوحظ أنه من المفيد إحاطة الأطباق والأنابيب بالـ Parafelm لمنع التبخير وتعريض الأنسجة لدرجة إضاءة خافتة بما لا يزيد عن 250 Lux .
3- تعديل المحتوى الغازى Modification of the gases environment
إشارة Bridgen et al 1978 على إمكانية زيادة الأنسجة على التخزين بتعديل الظروف الغازية للزراعات وذلك بخفض الضغط الجوى حتى 40 mm Hg وخفض الأكسجين إلى 7.6 mm Hg فقد لاحظ أن ذلك يؤدى إلى خفض معدل نمو الكلس فى كل من النباتات التالية Chrysanthemum marifaluin , Lycopersicon esculentum , Nicotiana tabacum .
4- التخزين فى النيتروجين السائل Storage in liquid nitrogen
تستخدم تلك الطريقة لتخزين الأعضاء النباتية مثل القمم النامية وفيه تغمس القمة النامية فى محلول Dimethyl sulphaxide بتركيز 10 % ( DMSO ) والمذابة فى بيئة غذائية مضاف إليها بنزيل الأدنين بتركيز 1 مليجرام / لتر لمدة ساعة حيث حيث تقوم المادة السابقة بتغطية القمم النامية لحمايتها من البرودة ثم تغمس القمم النامية على عمق 6 سم فى النيتروجين السائل وتخزن بذلك الأسلوب للمدة المطلوبة وعند الانتهاء من فترة التخزين والرغبة فى إذابة الثلج Thaw frozen تغمس القمم النامية فى بيئة حرارتها 34 °م وتزرع على بيئة غذائية ملائمة وتحت درجة حرارة 22 °م وإضاءة 4000 Lux فتستأنف نموها .

|

|
|















 المواضيع المتشابهه
المواضيع المتشابهه